 钟柱宏,李锦聪
钟柱宏,李锦聪 2026-02-04
2026-02-04| 已使用化妆品原料目录序号 | 02595 |
| 标准中文名称 | 寡肽-1 |
| INCI英文名称 | OLIGOPEPTIDE-1 |
| 日本化妆品原料名称 | オリゴペプチド-1 |
| 韩文化妆品原料名称 | 올리고펩타이드-1 |
| 常见使用目的 | 皮肤保护剂 |
| CAS No号 | |
| EC No号 | |
| 可能含有的风险物质 | 无 |
| 中国淋洗类产品最高历史使用量(%) | |
| 中国驻留类产品最高历史使用量(%) | 6.8175 |
| 权威机构淋洗类产品安全用量(%) | **** |
| 权威机构驻留类产品安全用量(%) | **** |
| 已使用化妆品原料目录备注 | |
| 化妆品安全技术规范要求 | |
| 标签警示语 | |
| 相关法规文件及权威机构报告 | |
| 已上市产品原料使用信息新 完整版安评可用 | 全身[驻留]:6.8175% 眼部[驻留]:0.00000001% |
| 中国最高历史使用量或权威机构数据 | |
| 牙膏技术规范要求 | |
| 牙膏原料目录(协会版) |

李锦聪
已使用化妆品原料目录序号: 02595
常见使用目的: 皮肤保护剂
CAS号:
可能含有的风险物质: 无
中国淋洗类最高历史使用量(%):
中国驻留类最高历史使用量(%): 6.8175
已使用化妆品原料目录备注:
化妆品安全技术规范要求:
权威机构淋洗类安全用量(%):
权威机构淋洗类评估结论:
权威机构驻留类安全用量(%):
权威机构驻留类评估结论:
已上市产品原料使用信息:
全身[驻留]:6.8175%
眼部[驻留]:0.00000001%
文献:
绿翊(广州)技术服务有限公司
数据来源:www.lv-1.cn
评估人:

日期: 2026-02-04
寡肽-1 (OLIGOPEPTIDE-1 )是一种常用的化妆品原料,CAS No号为 ,EC No号为 。其标准中文名称为: 寡肽-1 ;INCI英文名称为: OLIGOPEPTIDE-1 ;日本化妆品原料名称为: オリゴペプチド-1 ;韩文化妆品原料名称为: 올리고펩타이드-1 。 寡肽-1 用于化妆品中常见使用目的与功效作用为: 皮肤保护剂 等多用用途。已列入《已使用化妆品原料目录(2021年版)》,不属于《化妆品安全技术规范(2015年版)》中的禁用物质。
根据《化妆品安全评估导则(2021年版)》,自2024年5月1日起,我国化妆品将实施完整版安全评估政策,完整版安全评估一般按照以下证据进行评估以确定其安全性:
首先判断是否是《化妆品安全技术规范》中的限用组分、准用防腐剂、准用防晒剂、准用着色剂和准用染发剂列表中的原料、有限制要求的风险物质应满足《化妆品安全技术规范》要求,具体要求见本文说明或查阅《化妆品安全技术规范》。如果不属于《化妆品安全技术规范》的原料就考虑采用其他证据进行评估。
注:《化妆品安全技术规范》属于强制性要求,必须先符合规范要求,再参考其他证据。
除《化妆品安全技术规范》以外,其次就是国内外权威机构证据,如世界卫生组织(WHO)、联合国粮农组织(FAO)、欧盟消费者安全科学委员会(SCCS)、美国化妆品原料评价委员会(CIR)等已公布的安全限量或结论,如化妆品安全使用结论、每日允许摄入量、每日耐受剂量、参考剂量、一般认为安全物质(GRAS)等,国际日用香料协会(IFRA)已发布的香料原料标准等,如有限制条件(如刺激性要求等),在符合其限制条件下,结合原料历史使用浓度、产品或原料毒理学测试或人体临床测试结果,可采用其限量或结论;只有系统毒性评估结论的,结合原料历史使用浓度、产品或原料毒理学测试结果或人体临床测试结果,对产品刺激性等局部毒性进行评估后,可采用其限量或结论。
评估结论格式:美国化妆品原料评价委员会(CIR)评估结果显示,浓度不高于x.x%时该原料在(淋洗类/驻留类)化妆品中的使用是安全的,该原料的添加量为x.x%,在本产品中应用风险在可接受范围之内。
权威机构文献: 🔎 点击搜索
当我们能找到这部分的数据,评估难度将会大大降低,如果没有找到这部分的数据,就要进行原料的完整版安全评估,需要网上检索搜集该原料的每项毒理学终点数据。
一、本原料使用信息是对我国注册备案有效化妆品中已使用、未收录在《化妆品安全技术规范》《国际权威机构化妆品安全评估索引》中原料使用信息的客观收录。未组织对所列原料的安全性进行系统评价,化妆品注册人、备案人在使用相关原料信息时,应当符合国家有关法律法规、标准、规范的相关要求,开展化妆品安全评估并承担产品质量安全责任。
二、其载明的原料使用量,可为化妆品安全评估提供参考,化妆品注册人、备案人应当结合产品使用方法和作用部位,对数据的适用性进行评估,正确使用原料使用量。
三、相同作用部位的同一原料,若只有驻留类产品的原料使用量,淋洗类产品可参照驻留类使用。
四、相同使用方法的同一原料,可按照全身、躯干部位、面部(含颈部)、手足、头部、头发、口唇、眼部、指(趾)甲的顺序,后面作用部位可参照前面作用部位的原料使用量,但产品作用部位为眼部且参考其他部位使用量时,需另外评估眼刺激性。其中,口唇、眼部不可参照手足、头部、头发的原料使用量。
体毛仅可参照全身或躯干部位的原料使用量。作用部位同时为头部和头发,可参照头部的原料使用量;作用部位同时为面部(含颈部)、眼部和/或口唇,可参照面部(含颈部)的原料使用量,作用部位包括眼部时,需另外评估眼刺激性;对于其他同时用于多个作用部位产品的原料使用量,选择使用相同使用方法的上一级作用部位的使用量。
全身[驻留]:6.8175%
眼部[驻留]:0.00000001%
对于化学结构明确,且不包含严重致突变警告结构的原料或风险物质,含量较低且缺乏系统毒理学研究数据时,可参考使用毒理学关注阈值(TTC)方法进行评估,但该方法不适用于金属或金属化合物、强致癌物(如黄曲霉毒素、亚硝基化合物、联苯胺类和肼等)、蛋白质、类固醇、高分子质量的物质、有很强生物蓄积性物质以及放射性化学物质和化学结构未知的混合物等。
对于缺乏系统毒理学研究数据的非功效成分或风险物质,可参考使用分组/交叉参照(Grouping/Read Across)进行评估。所参照的化学物与该原料或风险物质有相似的化学结构,相同的代谢途径和化学/生物反应性,其中结构相似性表现在:(1)各化学物质具有相同的官能团(如醛类、环氧化物、酯类、特殊金属离子物质);(2)各化学物质具有相同的组分或被归为相同的危害级别,具有相似的碳链长度;(3)各化学物质在结构上(如碳链长度)呈现递增或保持不变的特征,这种特征可以通过观察各化学物质的理化特性得到;(4)各化学物质由于结构的相似性,通过化学物质或生物作用后,具有相同的前驱体或降解产物可能性。
中文名称:己基癸醇,《已使用化妆品原料目录(2021年版)》中3202号
INCI名称/英文名称:HEXYLDECANOL
CAS号:2425-77-6
化妆品中浓度及使用产品类别:0.0001%,身体乳
分子式:C16H34O
结构式:
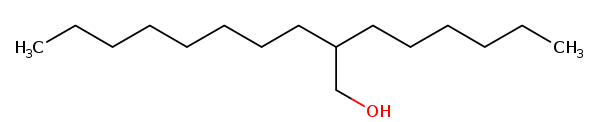
己基癸醇的化学结构图
物理状态:无色液体
熔点/凝固点:-69℃
相对密度:0.8369,20℃
沸点:300℃
蒸汽压:0.004 mbar,38℃
溶解度:<1 mg/L
脂水分配系数:6.66
闪点:159℃
燃点:238℃
粘度:41.1 mPa s,20℃
急性毒性:根据供应商测试,该原料在大鼠急性经口毒性试验中,LD0>2000 mg/kg bw且无动物死亡,表明该原料急性经口毒性为低毒性;
皮肤刺激性:在家兔多次皮肤刺激试验中,采用0.1%的该原料进行试验,显示该成分为无刺激性;
皮肤光毒性和光变态反应:采用0.1%的该原料进行试验,未见皮肤光毒性和光变态反应;
皮肤致敏性:根据供应商测试,局部封闭涂皮(Buehler Test, BT)试验中,采用0.1%的该原料进行诱导接触和激发接触,未见皮肤变态反应;
遗传毒性:细菌回复突变试验和体外染色体畸变试验结果显示,己基癸醇未引起基因突变和染色剂畸变;
其他系统毒性:未收集到该成分系统毒性信息。
4.1判断待评估物质是否符合TTC使用范围
已知待评估物质的化学结构,在身体乳中的含量较低,主要暴露途径为经皮,暴露量可计算,缺乏系统毒理学数据,且不属于需排除的情形,故可用TTC法进行评估。
4.2计算全身暴露量
用以下公式计算:
式中,A为以单位体重计的化妆品每天使用量[mg/(kg bw·d)],可参考《The SCCS's Notes of Guidance for the Testing of Cosmetic Substances and Their Safety Evaluation-12th Revision》;C为该化合物在产品中的浓度(%);DAp为经皮吸收率(%),默认的经皮吸收率为100%
因此,SED = 7.82×106×0.0001×1×1/(60×100) = 0.13µg/kg/day
4.3待评估物质是否为潜在DNA反应性致突变物/致癌物该物质为非潜在DNA反应性致突变物/致癌物。
该物质为非潜在DNA反应性致突变物/致癌物。
4.4结论
根据物质分类原则或使用分类软件(如欧洲化学品管理局开发的Toxtree、经济合作与发展组织开发的QSAR Toolbox等)并经确认,己基癸醇属于Cramer I类物质。身体乳中浓度为0.0001%的己基癸醇的全身暴露量为0.13µg/kg/day,小于Cramer I类物质的毒理学关注阈值46 µg/kg/day。
综上所述,对己基癸醇的局部毒性、遗传毒性和TTC评价结果等信息进行综合评价,认为身体乳中使用浓度为0.0001%的己基癸醇时,在正常、合理的及可预见的使用条件下,不会对人体健康产生危害。
略。
化妆品毒理学终点一般分为两大类,局部毒性:皮肤和刺激性/腐蚀性;眼睛刺激性/腐蚀性;皮肤致敏性(皮肤变态反应);皮肤光毒性/光敏性;人体斑贴试验等。系统毒性:急性经口毒性;急性经皮毒性;急性吸入毒性;遗传毒性;重复剂量毒性(亚慢性);生殖发育毒性;慢性毒性/致癌性;毒代动力学等。这部分的数据一般在在欧洲化学品管理局(ECHA)网站中检索搜集。
化妆品原料的安全评估,其中局部毒性是强制性要求,必须确保局部为无刺激或轻刺激(不得出现腐蚀性),无皮肤致敏性,无光毒性和光敏性。局部毒性可以是公开发表的科学研究、调查、评估报告和著作等数据,当这部分有数据缺口时,可以通过原料或产品送检加测毒理学试验项目进行数据补充。
解决了原料的局部毒性以后,还要继续检索搜集原料的各项系统毒性数据,其中重复剂量毒性(亚慢性)是关键项,因为找到原料的重复剂量数据,可以进行下一步的剂量反应关系评估,如:重复剂量毒性可以得到的90天或20天的NOAEL、LOAEL或BMD、BMDL。
第一步计算原料的全身暴露量(SED):
A:以单位体重计的化妆品每天使用量(mg/kg·bw/day)
C:在产品中的浓度(%)
DAp:经皮吸收率(%)
计算公式:SED=A×C×DAp
第二步计算原料的安全边际值(MoS):
MoS:安全边际值
NOAEL:未观察到有害作用的剂量
BMD:基准剂量
SED:全身暴露量(mg/kg·bw/day)
计算公式:MoS=NOAEL(BMD)÷SED
在通常情况下, 当MoS≥100时,可以判定是安全的。
最后还要确定原料是否具有遗传毒性、生殖发育毒性、慢性毒性/致癌性等,系统毒性也可以是公开发表的科学研究、调查、评估报告和著作等数据,当这部分有数据缺口时,可以通过原料或产品送检加测毒理学试验项目进行数据补充。
如果您遇到原料安全评估难题时,可以联系我们技术人员,我们能提供原料完整版评估服务。
来源:绿翊(广州)技术服务有限公司
![]() 附件:Safety Assessment of OLIGOPEPTIDE-1 as Used in Cosmetics.pdf
附件:Safety Assessment of OLIGOPEPTIDE-1 as Used in Cosmetics.pdf
See how this product scores for common concerns.
无 中国化妆品最高历史使用量吗?
无 国际权威评估结果安全用量吗?
有 最高历史使用量或CIR安全用量,但配方中使用超过了吗?
想通过毒理学数据完整版安全评估,节省毒理试验费用吗?

需要完整版评估可以微信扫码联系我们(付费增值服务)



联系我们

关注公众号
